Cuando un sistema
contiene cantidades superiores de soluto que la cantidad permitida por su solubilidad,
se encuentra en una situación inestable desde el punto de vista termodinámico
(sistema sobresaturado) y más tarde o más temprano cristaliza
para alcanzar el equilibrio. El tiempo que un sistema sobresaturado tarda en
precipitar puede durar desde segundos a años y depende de factores cinéticos,
causa por la cual no se producen en el organismo, en condiciones normales, cristalizaciones
indiscriminadas, a pesar de encontrase los fluidos biológicos sobresaturados
en algunas sustancias. De hecho son tres los aspectos principales que deben
considerarse para explicar las cristalizaciones patológicas: sobresaturación
superior al valor habitual (factor termodinámico), la presencia de nucleantes
heterogéneos (promotores de la cristalización), tales como macromoléculas,
restos celulares, lesiones epiteliales... (factor cinético), y/o el déficit
de inhibidores de la cristalización, que son sustancias que impiden o
dificultan el desarrollo de los cristales (factor cinético) [1-2]. En
condiciones fisiológicas estos factores normalmente se compensan evitando
la formación de cristales. Ahora bien, al producirse una ligera modificación
de alguno de ellos, de modo que se rompa ese balance, se producen cristalizaciones
indiscriminadas que acaban provocando procesos patológicos.
Cabe señalar que en condiciones fisiológicas, la sobresaturación
no se mantiene invariable sino que oscila dentro de unos límites, por
ello unos niveles adecuados de inhibidores de la cristalización son esenciales
cuando la sobresaturación alcanza su valor máximo puesto que evitan
que se formen partículas sólidas hasta que de nuevo se alcanzan
los niveles óptimos.
De acuerdo con lo que se ha comentado, la formación de cálculos
renales es un problema multifactorial en el que deben considerarse factores
de riesgo relacionados tanto con la composición de la orina como con
la morfología renal. Los factores relacionados con la composición
de la orina son fundamentalmente: la sobresaturación excesiva de las
sustancias potencialmente litógenas, el déficit de inhibidores
de la cristalización y la presencia de nucleantes heterogéneos.
Los factores relacionados con la morfología renal son principalmente:
la presencia de cavidades de baja eficacia urodinámica donde queda retenida
la orina durante largos períodos de tiempo y las alteraciones que puedan
producirse sobre el epitelio que recubre la papila renal como es una reducción
de la capa antiadherente de glucosaminoglucanos, necrosis, etc. El desarrollo
de cálculos renales generalmente depende de la coexistencia de diversos
factores alterados, no obstante en la mayoría de los casos corrigiendo
algunos de estos factores, no necesariamente todos, se evita el desarrollo de
nuevos cálculos.
Numerosos estudios epidemiológicos ponen de manifiesto la relación
existente entre la litiasis renal y una baja ingesta de fitato.
 |
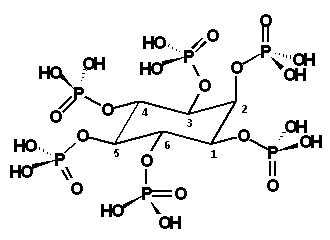
Figura 1.- Estructura del fitato o ácido myo-inositol 1,2,3,4,5,6-hexakis(dihidrogenofosfato) (IUPAC, 1968). |
Así, en la población de Sudáfrica constituida principalmente por dos grupos étnicos, población de origen europeo y población de origen africano, la incidencia de cálculos renales en la población de origen europeo es superior a la población de origen africano. Esta diferencia se ha atribuido a una diferente composición urinaria debida a los diferentes hábitos alimentarios. Así, la población de origen africano consume abundante pan integral, maíz, guisantes secos, frutas, algunos vegetales y alimentos de origen animal y, a pesar de incorporar nuevos alimentos, aún sigue la antigua tradición. La gran diferencia entre los dos grupos reside en la ingesta de fósforo, ya que la población de origen europeo ingiere la mayor parte de fósforo en forma de fosfato inorgánico mientras que la población de origen africano tiene una fuente importante de fósforo como fitato [3]. Por tanto, el fitato podría ser la causa de la baja incidencia de litiasis renal en el grupo de población de origen africano de acuerdo con la hipótesis de Modlin [4]. En otro estudio en el que se comparó la ingesta de fitato en pacientes con litiasis renal oxalocálcica idiopática frente a un grupo control, se comprobó que la ingesta de esta sustancia era significativamente inferior en el grupo de litiásicos [5]. De hecho, la incidencia de litiasis renal cálcica en los países con un consumo elevado en cereales no refinados, ricos en fitato, resulta ser inferior a la de los países más industrializados donde se consumen cereales refinados [6]. Estudios recientes también han puesto de manifiesto que los niveles urinarios de fitato eran inferiores en el grupo de litiásicos oxalocálcicos respecto al grupo control de individuos sanos [7].
Recientemente se ha demostrado que el fitato actúa como un inhibidor
muy efectivo de la nucleación heterogénea del oxalato cálcico
[8-9], de la nucleación homogénea del fosfato cálcico [10]
y del crecimiento cristalino del oxalato cálcico [11]. Los efectos que
el fitato ejerce sobre las primeras etapas de formación de los cálculos
de oxalato cálcico se estudiaron in vitro utilizando sistemas que simulan
las condiciones de formación de los cálculos en el interior del
riñón [15-18]. En estos estudios se demostró claramente
que el fitato actúa de un modo muy eficaz impidiendo la formación
de cristales de oxalato cálcico mediante nucleación heterogénea.
Cabe señalar que debido a las condiciones de sobresaturación urinaria
respecto al oxalato cálcico, incluso en individuos hipercalciúricos
o hiperoxalúricos, la formación de cristales de oxalato cálcico
a través de un mecanismo de nucleación homogénea resulta
prácticamente imposible [17].
También se ha estudiado el efecto del fitato sobre el desarrollo de depósitos
de oxalato cálcico sobre la papila renal en ratas Wistar a las que se
suministró etilenglicol como agente litiásico. El análisis
macroscópico y microscópico de los riñones demostró
que las ratas a las que se suministraba fitato junto con la dieta litógena
presentaban un menor contenido en calcio y calcificaciones en la papila renal
[18]. El fitato también previno de un modo muy eficaz la aparición
de calcificaciones en el tejido renal de animales alimentados con una dieta
carente de fitato [19].
Resulta interesante observar que el fitato se ha utilizado previamente para
el tratamiento de la litiasis renal. Así, en 1958, Henneman utilizó
elevadas dosis de fitato, en forma de fitato sódico (8,8 g/día),
para el tratamiento de enfermos litiásicos con problemas de hipercalciuria
idiopática [20]. El objetivo y fundamento de este tratamiento era, sin
embargo, la formación en el tracto digestivo de complejos insolubles
de calcio a fin de disminuir su absorción intestinal.
Los posibles efectos terapéuticos del fitato en el tratamiento de la
litiasis renal quedan evidenciados si se considera que la capacidad inhibidora
del fitato en la cristalización del oxalato cálcico es mil veces
superior a la que presenta el citrato y que la ingesta de pequeñas dosis
de fitato puede incrementar la capacidad inhibidora de la orina en un 50-100%
[21]. Un estudio reciente llevado a cabo con enfermos litiásicos oxalocálcicos
demostró que el riesgo urinario de desarrollar litiasis cálcicas
se redujo notablemente con la ingesta de fitato sin que se alterara ningún
otro parámetro urinario [22].
Como ya hemos indicado, la administración de elevadas dosis de fitato
sódico a pacientes hipercalciúricos tenía como objetivo
la formación en el tracto digestivo de complejos insolubles de calcio
a fin de disminuir su absorción intestinal. En cambio el consumo dietético
de bajas dosis de fitato, en forma de fitato cálcico-magnésico
o fitina, supone un nuevo enfoque que consiste en aumentar la capacidad inhibidora
de la orina frente a la cristalización del oxalato cálcico y del
fosfato cálcico, actuando de esta forma en la prevención de la
litiasis renal cálcica.
Absorción, distribución, excreción y toxicidad del fitato
Estudios realizados en animales de experimentación demostraron que los niveles de fitato en el organismo se encontraban directamente relacionados con su ingesta oral, alcanzándose unos niveles plasmáticos máximos tanto con una dieta que contenía un 1% de fitato en forma de sal sódica, como con la misma dieta conteniendo un 0,12% de fitato en forma de sal cálcico-magnésica (fitina) proveniente de germen de garrofín [23].
De hecho, al eliminar
completamente el fitato de la dieta, la concentración urinaria disminuyó
hasta valores no detectables a los 22 días de haberse suprimido su consumo
[24]. La adición de cantidades crecientes de fitato a una dieta carente
del mismo demostró que con un consumo de fitato de 20,9 mg por kg de
peso corporal, se alcanzaba la máxima excreción urinaria, que
correspondía al 2% de la cantidad ingerida, y que aumentos posteriores
en el consumo de fitato no originaban aumentos en la excreción urinaria
[24].
En humanos, la eliminación total del fitato de la dieta durante un periodo
de 36 horas produjo una disminución de los niveles urinarios cercana
al 50% [7]. El estudio de la absorción y excreción urinaria de
fitato administrado oralmente a humanos demostró que después de
un periodo de dos semanas de consumir una dieta pobre en fitato los niveles
en orina de dos horas, disminuyeron alrededor del 90% y los niveles plasmáticos
un 74% [25]
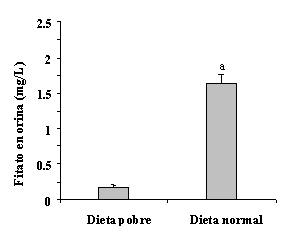 |
Figura 2.- Niveles urinarios de fitato después de seguir una dieta pobre en fitato y una dieta normal en fitato. Los valores se expresan como el valor medio de siete voluntarios ± SEM. a p < 0.05 vs. dieta pobre [25]. |
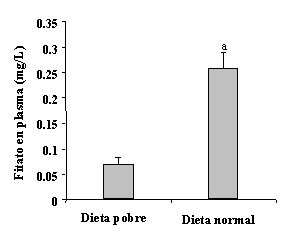 |
Figura 3.- Niveles plasmáticos de fitato después de seguir una dieta pobre en fitato y una dieta normal en fitato. Los valores se expresan como el valor medio de siete voluntarios ± SEM. a p < 0.05 vs. dieta pobre [25]. |
Se deduce de nuevo que los niveles urinarios y plasmáticos de fitato
dependen básicamente de su ingesta con la dieta, y que el organismo no
es capaz de producir síntesis endógena de novo a partir del inositol
para mantener unos niveles normales. Estos estudios también evidenciaron
que el fitato se absorbe rápidamente, aunque en un bajo porcentaje del
administrado oralmente, presentando un máximo de absorción a las
4 horas de su ingesta [25].
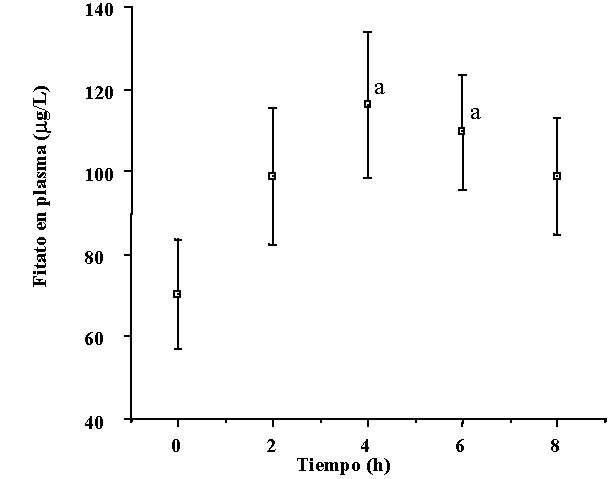 |
Figura. 4.- Cinética de absorción del fitato tras la ingesta de una única dosis de 1400 mg de fitato después de seguir durante un período de dos semanas una dieta pobre en fitato. Los valores se expresan como el valor medio de los siete voluntarios ± SEM. a p < 0.05 vs. el valor correspondiente a 0 horas [15]. |
Con la administración a sujetos sometidos a dietas pobres en fitato de
tres dosis y sales diferentes correspondientes a 400 mg de fitina (308 mg de
fitato), 3200 mg de fitina (2470 mg de fitato) y 1400 mg de fitato sódico
(1000 mg de fitato), no se observaron diferencias estadísticamente significativas
en los valores de fitato urinario excretados [25]. Dado que un aumento en más
de 6 veces la dosis ingerida no producía un incremento considerable de
la excreción urinaria de fitato, estos resultados concuerdan totalmente
con los estudios realizados con animales de experimentación, en el sentido
de demostrar que con dosis bajas de fitato se alcanzan valores de excreción
urinaria máximos. Por otra parte, estos resultados también demuestran
que las cantidades de fitato excretadas en la orina no se modifican con el tipo
de sal suministrada.
 |
Figura 5.- Incremento cada dos horas de la excreción urinaria de fitato referido a la primera muestra de orina, tras la ingesta de una dosis de 400 mg de fitina, 3.200 mg de fitina y 1.400 mg de fitato sódico, después de seguir durante dos semanas previas una dieta pobre en fitato. Los valores se expresan como el valor medio de los siete voluntarios ± SEM. a p < 0.05 vs. 2 horas y b p < 0.05 vs. 4 horas [15]. |
Ello posiblemente sea debido a que una parte importante de la absorción del fitato tenga lugar a través de la mucosa de la pared estomacal en forma de especie protonada, siendo por tanto independiente de la sal inicial suministrada.
En los mismos sujetos, el consumo de una dieta con un contenido normal en fitato,
transcurridos 15 días con una dieta pobre en fitato, produjo un aumento
paulatino del contenido de fitato en el organismo, tal como puede observarse:
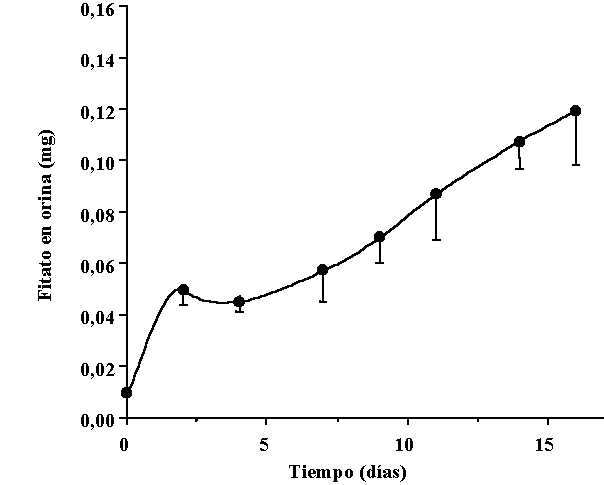 |
Figura 6.- Incremento de la excreción urinaria de fitato en orina de 2 horas, en siete voluntarios siguiendo una dieta normal en fitato después de un periodo de dos semanas de consumir una dieta pobre en fitato (t = 0). Los valores se expresan como el valor medio de los siete voluntarios ± SEM [15]. |
Sin embargo, a
los 16 días aún no se habían estabilizado los valores alcanzados
[25]. Como puede apreciarse los valores de concentración plasmática
del fitato estaban directamente relacionados con los de su excreción
urinaria producida durante las dos horas anteriores a la recogida de la muestra
sanguínea [25].
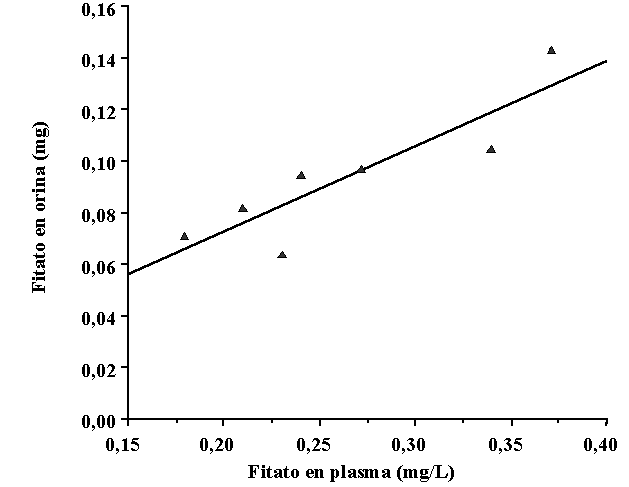 |
Figura 7.Correlación entre los niveles de fitato plasmático y la excreción urinaria de fitato producida durante las dos horas anteriores a la recogida de la muestra de sangre en siete voluntarios sometidos a una dieta normal [15]. |
Ello demuestra que la concentración de fitato urinario puede utilizarse
como un marcador del estatus de fitato en el organismo. En este aspecto debemos
considerar que la dieta humana es, en la mayoría de las ocasiones, una
dieta bastante variada, de modo que el consumo de fitato no es regular, contrariamente
a lo que ocurre con los animales de experimentación a los que se les
suministra continuamente la misma dieta, de ahí que los niveles urinarios
se incrementen y estabilicen más rápidamente en los animales de
experimentación.
Otros estudios demostraron que el fitato está distribuido en todos los
órganos y fluidos del organismo analizados. La determinación de
la concentración de fitato en animales de experimentación alimentados
con una dieta sintética en la cual el fitato se añadió
en forma de sal sódica, evidenció que las concentraciones variaban
según las características de los tejidos, desde valores de 0,2
mg/L en plasma hasta valores de 20 mg/g en el cerebro, mientras que cuando se
suministró la misma dieta carente de fitato los valores se redujeron
a 0,02 mg/L en plasma y 0,9 mg/g en cerebro [26].
Tabla I. Distribución de fitato en órganos y fluidos corporales
de ratas alimentadas con una dieta con un 1% de fitato sódico y dieta
sin fitato. La concentración tisular se expresa sobre producto de tejido
seco.
| Dieta |
CON
FITATO
|
SIN
FITATO
|
| Orina (mg/l) |
2,51
|
no
detectable
|
| Plasma (mg/l) |
0,19
|
0,02
|
| Riñón(mg/g) |
1,44
|
0,04
|
| Hígado(mg/g) |
2,26
|
no
detectable
|
| Hueso (fémur) (mg/g) |
1,40
|
no
detectable
|
| Cerebro (mg/g) |
20,16
|
0,90
|
Finalmente debemos señalar que los estudios de toxicidad aguda del ácido fítico y del fitato sódico, administrados por vía oral, con ratas y ratones determinaron una DL50 situada entre 400 y 2.750 mg/kg [27-28].
BIBLIOGRAFIA
1. Grases F, Costa-Bauzá A. Phytate is a powerful agent for preventing
calcifications in biological fluids: usefulness in renal lithiasis treatment.
Anticancer Res 1999; 19: 3717-3722.
2. Grases F, Costa-Bauzá A, Königsberger E, Königsberger L-C. Kinetic versus thermodynamic factors in calcium renal lithiasis. Int Urol Nephrol 2000; 32: 19-27.
3. Modlin M. The aetiology of renal stones: a new concept rising from studies
on a stone free population. Ann R Coll Surg England 1967; 40: 155-159
.
4. Modlin M. Urinary phosphorylated inositols and renal stone. Lancet 1980;
2: 1113-1114.
5. Griffith HM, Oshea B, Maguire M, Koegh B, Kevany JP. A case-control study
of dietary intake of renal stone patiens. II. Urine biochemistry and stone analysis.
Urol Res 1986; 14: 75-82.
6. Andersen DA. Historical and geographical differences in the pattern of incidence
of urinary stones considered in relation to possible aetiological factors. En:
Renal Stone Research Symp Pags. 7-16. Hodgkinson A y Nordin BEC Eds. Churchill.
1969; Londres.
7. Grases F, March JG, Prieto RM, Simonet BM, Costa-Bauzá A, García-Raja
A, Conte A. Urinary phytate in calcium oxalate stone formers and healthy people.
Dietary effects on phytate excretion. Scand J Urol Nephrol 2000; 34: 162-164.
8. Grases F, Kroupa M, Costa-Bauzá A. Studies on calcium oxalate monohydrate
crystallization. Influence of inhibitors. Urol Res 1994; 22: 39-43.
9. Grases F, Costa-Bauzá A. Potentiometric study of the nucleation of
calcium oxalate in presence of several additives. Clin Chem Enzym Comms 1991;
3: 319-328.
10. Grases F, Ramis M, Costa-Bauzá A. Effects of phytate and pyrophosphate
on brushite and hydroxyapatite crystallization. Comparison with the action of
other polyphosphates. Urol Res 2000; 28: 136-140.
11. Grases F, March P. A study about some phosphate derivatives as inhibitors
of calcium oxalate crystal growth. J Crystal Growth 1989; 96: 993-995
12. Grases F, García-Ferragut L, Costa-Bauzá A. Study of the early
stages of renal stone formation. Experimental model using urothelium of pig
urinary bladder. Urol Res 1996; 24: 305-311.
13. Grases F, García-Ferragut L,Costa-Bauzá A, March JG. Study
of the effects of different substances on the early stages of papillary stone
formation. Nephron 1996; 73: 561-568.
14. Grases F, Costa-Bauzá A, March JG. Artificial simulation of the early
stages of renal stone formation. Brit J Urol 1994; 74: 298-301.
15. Grases F, García-Ferragut L, Costa-Bauzá A. Development of
calcium oxalate crystals on urothelium: effect of free radicals. Nephron 1998;
78: 296-301.
16. Grases F, Llobera A. Experimental model to study sedimentary kidney stones.
Micron 1998; 29: 105-111.
17. Finlayson B. Physicochemical aspects of urolithiasis. Kidney Int 1978; 13:
344-360.
18. Grases F, García-Gonzalez R, Torres JJ, Llobera A. The effects of
phytic acid on renal stone formation in rats. Scand J Urol Nephrol 1998; 32:
261-265.
19. Grases F., Prieto R.M., Simonet B.M., March J.G. (2000) Phytate prevents
tissue calcifications in female rats. BioFactors 11: 171-177
20. Henneman PH, Benedict PH, Forbes AP, Dudley HR. Idiopathic hypercalciuria.
N Eng J Med 1958; 17: 802-807.
21. Grases F, García-Ferragut L, Costa-Bauzá A. A new procedure
to evaluate the inhibitory capacity of calcium oxalate crystallization in whole
urine. Int Urol Nephrol 1995; 27: 653-661.
22. Conte A, Pizá P, García-Raja A, Grases F, Costa-Bauzá
A, Prieto RM. Urinary lithogen risk test: usefulness in the evaluation of renal
lithiasis treatment using crystallization inhibitors (citrate and phytate).
Arch Esp Urol 1999; 52: 305-310.
23. Grases F, Simonet BM, Prieto RM, March JG. Dietary phytate and mineral bioavailibility.
J Trace Elem Med Biol 2001; 15: 221-228.
24. Grases F, Simonet
BM, March JG, Prieto RM. Inositol hexakisphosphate in urine: the relationship
between oral intake and urinary excretion. BJU Int 2000; 85: 138-142.
25. Grases F, Simonet BM, Vucenik I, Prieto RM, Costa-Bauzá A, March
JG, Shamsuddin AM. Absorption and excretion of orally administered inositol
hexaphosphate (IP6 or phytate) in humans. BioFactors 2001; 15: 53-61.
26. Grases F, Simonet BM, Prieto RM, March JG. Phytate levels in diverse rat
tissues: influence of dietary phytate. Brit J Nutr 2001; 86: 1-8.
27. Fujitani T, Yoneyama M, Kabashima J, Hosokawa N, Ichikawa H. Acute toxicity
of phytic acid and sodium phytate in mice. Kenkyu Nenpo-Tokyo-toristu Eisei
Kenkyusho 1987; 38: 368-370.
28. Ichikawa H, Ohishi S, Takahashi O, Kobayashi H, Yuzawa K, Hosokawa N, Hashimoto
T. Acute oral toxicities of phytic acid and sodium phytate in rats. Kenkyu Nenpo-Tokyo-toristu
Eisei Kenkyusho 1987; 38: 371-376.